Aluminio en antitranspirantes baja contribución a la ingesta total de aluminio en humanos
Continuamos con la parte II de este tema…
Después de la aplicación, se pidió a los sujetos que usaran una camiseta de algodón durante 24 h, y luego se les permitió tomar una ducha y lavarse la zona de las axilas. En este estudio no se utilizó un vendaje o gasa para cubrir el área de piel expuesta. Se tomaron muestras de sangre en puntos específicos en el tiempo durante un período de 28 días después de la aplicación dérmica (Tabla 1), con el objetivo de reconstruir el curso concentración-tiempo en sangre de 26Al. Además, se recolectaron esporádicamente muestras de orina de la mañana (Tabla 1) para obtener alguna evidencia sobre la excreción urinaria de 26Al.
Se eligió un diseño cruzado para este estudio con el fin de investigar la influencia de (i) la aplicación diaria versus la aplicación única de antitranspirantes y (ii) el afeitado diario de las axilas versus no afeitarse el área de las axilas. Para hacerlo, se definieron tres regímenes de uso separados, dentro de los cuales la exposición a la formulación antitranspirante etiquetada con 26Al ocurrió una vez: estos involucraron el uso diario antes y después de la exposición de un estándar listo para usar (sin etiquetar) antitranspirante en la piel sin afeitar (régimen A) o afeitada (régimen B), así como sin el uso de ningún «tratamiento adicional» (régimen C). Con este fin, los 12 sujetos se dividieron en tres grupos de cuatro individuos. Los grupos diferían entre sí sólo en términos del orden en que siguieron los tres regímenes de uso (ver Figura 1). Después de completar los regímenes A, B y C, seguido de una fase de lavado de 4 semanas que no implicó el uso de ningún antitranspirante, los sujetos recibieron una única dosis intravenosa4. Esto implicó la inyección en bolo de 5 ml de una solución de citrato de aluminio marcada con 26Al (~ 1 Bq). Después de esto, se tomaron y recolectaron muestras de sangre y orina matutina durante un período de 28 días.
Después de la administración dérmica, las concentraciones de 26Al en sangre estuvieron por encima del límite de cuantificación (0,122 fg / ml) en solo 2 de 504 muestras, lo que impidió el cálculo de cualquier perfil de concentración-tiempo. Por lo tanto, no fue posible una determinación de la biodisponibilidad utilizando curvas de concentración en sangre-tiempo. En su lugar, los autores recurrieron al uso de los datos de las muestras de orina de la mañana recogidas después de la administración dérmica para determinar la acumulación excreción en la orina (ver más abajo). Resultó posible cuantificar 26Al en el 35% (87 de 252 muestras) de estas muestras de orina, aunque solo las muestras tomadas los días 1, 2 y 3 fueron generalmente cuantificables.
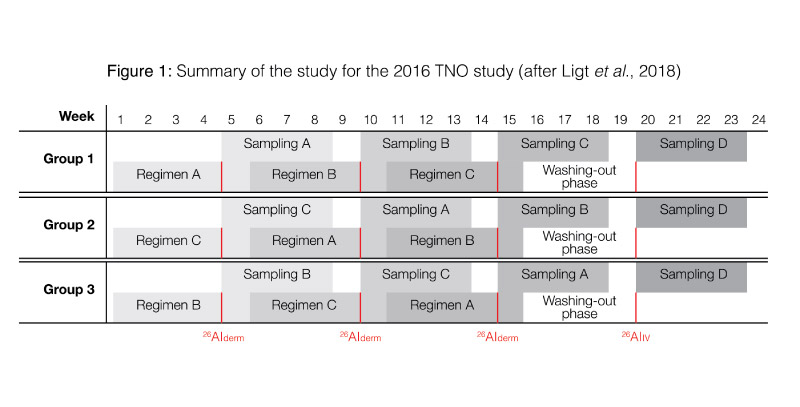
Para los diversos escenarios, el enfoque del mejor de los casos arrojó valores de biodisponibilidad de 0,0056% (régimen A) a 0,0100% (régimen C), mientras que el enfoque conservador del peor de los casos arrojó valores de 0,0100 (régimen A) a 0,0144% (régimen C). Como resultado de la gran variación en los datos, las diferencias entre los tres regímenes con respecto a la biodisponibilidad no fueron estadísticamente significativas.
TNO 2019
En este estudio, seis mujeres completaron una fase de adaptación de 2 semanas que incluyó un afeitado húmedo diario y el uso de un antitranspirante estándar antes de recibir una sola aplicación en ambas axilas de una formulación que contenía ACH marcado con 26Al que había sido espesado. con hidroxietilcelulosa. La cantidad total aplicada pesó 1,5 gy tuvo una actividad de 2695 Bq, lo que correspondió a una cantidad aplicada de 3732 ng de 26Al. Después de la aplicación de 0,75 g en cada axila (aprox. 100 cm2 de piel de la axila), el área tratada se dejó secar de forma natural antes de cubrirla con una gasa no oclusiva que se adhirió sin apretar sobre el área de aplicación. A continuación, se pidió a los sujetos que usaran una camiseta durante 24 h. El expuesto Luego se lavó el área de la piel y se cubrió con una gasa semioclusiva durante otras 24 h. Después de este período de 24 h, se volvió a lavar la zona de la piel. La solución de lavado, los demás materiales utilizados, las gasas y las camisetas usadas se analizaron luego para determinar la proporción de 26Al no absorbido. Para la dosis intravenosa, se administraron 5 ml de una solución de citrato de aluminio marcada con 26Al (~ 0,1 Bq) mediante una inyección en bolo.
Luego se tomaron muestras de sangre en puntos de tiempo específicos durante 28 días después de la aplicación dérmica. Además, la orina y las heces
se recolectaron en su totalidad durante un período de 10 días (referido a la recolección de orina (orina de6hy12h),orinade24hyhecesde24henlos siguientes casos); También se recogió orina de 24 h losdías14,21y28.Eldía7yeldía35despuésde la aplicación, también se realizó una «extracción de cinta» en una axila para determinar los residuos de 26Al en la capa córnea. Para ello, se eliminó el estrato córneo en capas individuales utilizando tiras de cinta hasta que la superficie brillante de la epidermis viable se hizo visible. También se tomó una biopsia de piel en el área de piel libre de su capa córnea después de 35 días, para determinar la cantidad de 26Al en las capas de piel debajo del estrato córneo. Dado que las concentraciones de 26Al en sangre estaban por encima del límite de cuantificación en solo 12 de 84 muestras, esto redujo la utilidad de los perfiles de concentración-tiempo resultantes. En este estudio no se pudieron derivar afirmaciones sólidas sobre la biodisponibilidad a partir de los perfiles de tiempo de concentración en sangre. En cambio, los autores recurrieron al uso de los datos de las muestras de orina recolectadas.
Después de la administración dérmica, fue posible cuantificar el 26Al en el 66% (59 de 90) de las muestras de orina recolectadas durante todo el período de observación. Hasta el día 6 (inclusive), la proporción de muestras de orina cuantificables fue del 90%. Después de la administración intravenosa, el porcentaje durante todo el período de tiempo fue del 98% (88 de 90 muestras). Para las últimas muestras tomadas (el día 28), la concentración de 26Al en todas las muestras estaba por debajo del límite de detección (administración dérmica) o cerca o por debajo del límite de detección (administración IV). Para calcular la excreción acumulada de 26Al, los valores por debajo del límite de cuantificación se establecieron en el límite de cuantificación (estimación del límite superior). En el caso de un sujeto, los datos toxicocinéticos sugirieron que la administración intravenosa prevista probablemente se produjo por vía intramuscular/subcutánea. Los datos obtenidos de este tema fueron excluidos de la estadística descriptiva. Durante todo el período de estudio, una media del 0,00036% (dérmica) y el 70% (IV) de la dosis aplicada se excretó en la orina (valor medio de 5 sujetos).
Al tomar la proporción de 26Al excretada en la orina después de la aplicación dérmica y multiplicarla por la proporción excretada en la orina después de la administración intravenosa, la fracción biodisponible después de la aplicación dérmica podría calcularse para cada uno de los cinco sujetos restantes (ver ecuación en la página 6). El valor medio de esta fracción biodisponible fue del 0,00052%.
En las heces, se recuperó de media el 0,0014% de la dosis dérmica. Las mediciones realizadas en las camisetas gastadas, las gasas, la solución de lavado y los utensilios utilizados arrojaron una tasa de recuperación del 70%. La mayor proporción se encontró a las 24 h en la solución de lavado (62%) y las camisetas (6%). Basado en el análisis de las tiras de cinta, la tasa de recuperación para la dosis aplicada de la capa córnea fue del 0,0097% (después de 7 días) y del 0,0090% (después de 35 días). La biopsia cutánea con punch (epidermis viva y dermis vecina) arrojó una recuperación tasa de 0,00004% después de 35 días (valor medio de dos muestras cuantificables).
Conclusiones
Los tres estudios en humanos sobre la biodisponibilidad del aluminio de los antitranspirantes aplicados por vía dérmica proporcionan un conjunto de resultados muy heterogéneo. Los valores oscilan entre el 0,014% (Flarend et al. 2001) y el 0,0056–0,0144% (TNO 2016), el 0,00052% (orina) y el 0,0014% (heces) (TNO 2019). Es necesario discutir tanto los aspectos aleatorios como los factores sistemáticos para identificar las posibles explicaciones de estas diferencias.
En el estudio de Flarend et al., el pequeño tamaño de la muestra puede haber ejercido un cierto grado de influencia como componente aleatorio (en términos de sesgo de muestreo/selección). Sin embargo, la BfR no considera este parámetro como el factor de influencia crucial para explicar la absorción 27 veces mayor en comparación con el estudio de TNO (2019). En cambio, las propiedades físicas y la composición de la formulación utilizada proporcionan la contribución decisiva a los resultados aquí. A saber: se aplicó una solución acuosa de ACH en lugar de una formulación cosmética viscosa.
Aparte de la cifra comparativamente alta de la absorción dérmica en sí, una peculiaridad adicional en Flarend et al., es que la tasa más o menos constante de excreción urinaria diaria de 26Al durante un período de 14 días, que contrasta con la disminución tanto en TNO (2016) como en TNO (2019) después del primer día posterior a la dosificación. Esto implica que el 26Al se volvió biodisponible a partir de un depósito dérmico de manera escalonada / retardada. La razón de esto podría ser una penetración más profunda de la solución acuosa en los conductos de las glándulas sudoríparas, lo que podría haber resultado en una exposición sistémica prolongada. A pesar de solo un caso de aplicación dérmica, esto podría explicar la tasa de absorción constante durante 14 días. Calculando hacia atrás durante este período, se obtendría una tasa de absorción dérmica de 0,001% por día.
La aplicación única en lugar de la aplicación diaria también conduce a una mayor absorción. El estudio de TNO (2016) muestra que en el caso del régimen C, comparable al diseño del estudio de Flarend et al., El enfoque del mejor caso conduciría a aproximadamente el doble de la cantidad de aluminio siendo absorbido a través de la piel en comparación con el régimen A o B (0,0100% frente a 0,0056% y 0,0058%). Suponiendo que la vía de absorción dérmica esté sujeta a saturación, el porcentaje de la cantidad absorbida depende en última instancia de la cantidad aplicada. Por encima de una cierta cantidad de aluminio aplicada, la absorción no aumenta más una vez que se alcanza este límite de saturación. Si se aplica aluminio por vía dérmica por encima de este límite de saturación, la fracción biodisponible disminuirá.
En el estudio de TNO (2016), la formulación antitranspirante se aplicó en una cantidad total 6 veces mayor y con una actividad aproximadamente 20 veces mayor en comparación con Flarend et al. (2001). El hecho de que, contrariamente a las expectativas de los autores, la concentración de 26Al en la sangre no fuera cuantificable es, en opinión del BfR, casi con certeza el resultado de una menor disponibilidad dérmica debido a las propiedades viscosas de la formulación (comercial estándar) también. como sensibilidad analítica, que fue de 1 a 2 órdenes de magnitud menor. La decisión de utilizar en su lugar los datos de las muestras de orina matutina, que se recolectaron esporádicamente y solo parcialmente analizables, requiere que se hagan una serie de suposiciones para estimar la excreción urinaria acumulada de 26Al. La estimación resultante está asociada con grandes incertidumbres.
La BfR considera que el momento en el que se tomó la primera muestra, es decir, 24 h después de la administración dérmica/intravenosa, es decisivo en términos de la tasa de absorción dérmica obtenida de esta manera. La concentración de 26Al en la primera muestra de orina de la mañana se utilizó para estimar la excreción de 26Al durante las primeras 24 h. Esta ventana de tiempo es una fase muy dinámica en la que las formas de las curvas de concentración de orina- tiempo difieren significativamente para la administración intravenosa y dérmica. Mientras que la primera curva muestra una caída exponencial, la segunda curva sigue una trayectoria inicialmente ascendente hasta un máximo antes de descender. Los datos proporcionados por el estudio de TNO (2019) indican que el máximo de excreción renal de 26Al se alcanza aproximadamente 24 h después de la aplicación dérmica. En base a los datos de la primera muestra de orina de la mañana, la excreción de 26Al durante las primeras 24 horas se subestima por lo tanto en el caso de la administración intravenosa y se sobreestima para la aplicación dérmica. Este error se
agrava aún más al utilizar ambos valores en un cálculo posterior. La consecuencia es una sobreestimación significativa de la excreción de 26Al durante las primeras 24 h, que es en última instancia la principal razón para sobreestimar la absorción dérmica.
En el estudio de TNO (2019), la actividad en la formulación antitranspirante se incrementó en un factor de 25 en comparación con la actividad en TNO (2016). Si bien esto aumentó la proporción de muestras de sangre cuantificables hasta cierto punto, los perfiles de concentración sanguínea-tiempo que pueden derivarse de este estudio son de confiabilidad limitada (ver arriba). Sin embargo, este estudio proporcionó un conjunto sólido de datos sobre la concentración de 26Al en la orina recolectada sistemáticamente, que luego podría utilizarse para determinar la excreción acumulada de 26Al. En consecuencia, el estudio de TNO (2019) se puede utilizar para derivar una biodisponibilidad sistémica del aluminio en los antitranspirantes tras la aplicación dérmica del 0,00192%, que comprende el 0,00052% y el 0,0014% en orina y heces, respectivamente.
Cuando se usan antitranspirantes en aerosol, la exposición dérmica al aluminio puede ir acompañada de una exposición no intencional al aluminio por inhalación. El SCCS ha completado una evaluación de riesgos para esta vía de exposición. El SCCS basó este trabajo en datos de expedientes (Meech et al. 2011, citado en SCCS (2020)). Aquí se consideraron tres fracciones de aerosol separadas y relevantes que difieren en términos de distribución de tamaño, que son capaces de llegar a los compartimentos principales de los pulmones (extratorácico, traqueobronquial y alveolar) (SCCS 2020). La cantidad de aluminio biodisponible por inhalación resultante del uso de un aerosol en aerosol estándar que contiene 2,86% de aluminio asciende a 0,010582 μg de Al/kg de peso corporal/día. Para un individuo de 60 kg, esto equivale a una exposición sistémica de 0,63492 μg Al/d.
En cuanto a la metodología, SCCS se refiere a un estudio experimental de Schwarz et al. (2018), en el que se modela y calcula en condiciones de uso la exposición al aluminio por inhalación de aerosoles (sin alcohol). Según Schwarz et al. (2018), menos de 0,5 μg de aluminio se vuelven disponibles sistémicamente por uso a partir de un spray que contiene 1,5% de aluminio. Si se usa dos veces al día, esto corresponde a una dosis diaria de 0,01666 μg / kg de peso corporal. Si se utiliza la concentración más alta de 2,86% de Al de la evaluación de SCCS, se obtiene una biodisponibilidad de 0,03154 μg de Al/kg de peso corporal/día. Suponiendo que los aerosoles utilizados aquí no difieran significativamente en términos de sus patrones de generación de aerosoles del aerosol considerado por el SCCS, el estudio de Schwarz et al. confirma los cálculos de SCCS.
Si se compara la inhalación con la vía dérmica en términos de exposición sistémica por aerosoles antitranspirantes, la biodisponibilidad de la exposición por inhalación es varios órdenes de magnitud mayor (en comparación con una biodisponibilidad dérmica del 0,00192%) y, por lo tanto, contribuye significativamente a la exposición general. A pesar de esto, el MoS para esta vía de exposición aún está dentro del rango de 20000 a 70000, ya que las cantidades disponibles por inhalación son muy pequeñas.
Más información sobre el tema en el sitio web de BfR …
https://www.bfr.bund.de/cm/349/faqs-about-aluminium- in-food-and-products-intended-forconsumers.pdf
Las sales de aluminio se utilizan en antitranspirantes para bloquear la sudoración e inhibir el mal olor. Desde hace mucho tiempo no se sabe con certeza cuánto aluminio de los antitranspirantes se absorbe a través de la piel. Actualmente hay tres estudios en humanos de 2001, 2016 y 2019 sobre la absorción de aluminio a través de la piel (absorción dérmica o biodisponibilidad) de los antitranspirantes. Los tres estudios se basan en medir la concentración de aluminio en sangre y/u orina. La conclusión científica y la relevancia científica de los tres estudios difieren considerablemente.
Solo el estudio de 2019 proporciona datos fiables sobre los que concluir sobre la tasa de absorción/ biodisponibilidad. El BfR utilizó estos datos como base para su evaluación de riesgos y de esto derivó la absorción a través de la piel en un cálculo modelo. El resultado fue que, según los datos actuales, es poco probable una contribución significativa de los antitranspirantes a la exposición total al aluminio.
Quienes deseen protegerse de la absorción excesiva de aluminio, deben asegurarse de que los alimentos y bebidas ácidos y salados no entren en contacto con el aluminio, por ejemplo, a través de botellas, bandejas para hornear, bandejas para grill.
Según los conocimientos científicos actuales, los niveles excesivos de aluminio en el organismo pueden tener efectos negativos sobre el sistema nervioso, los riñones y los huesos.

