Alumínio em antitranspirantes baixa contribuição para a ingestão total de alumínio em humanos
Após a aplicação, os sujeitos foram convidados a usar uma camiseta de algodão por 24 horas e, em seguida, autorizados a tomar banho e lavar a área das axares. Este estudo não ucou um curativo ou gaze para cobrir a área da pele exposta. Amostras de sangue foram colhidas em pontos específicos ao longo do tempo por um período de 28 dias após a aplicação dérmica (Tabela 1), com o objetivo de reconstruir o curso de tempo de concentração sanguínea 26al. Além disso, amostras de urina matinal foram coletadas esporadicamente (Tabela 1) para obter alguma evidência de excreção urinária do 26Al.
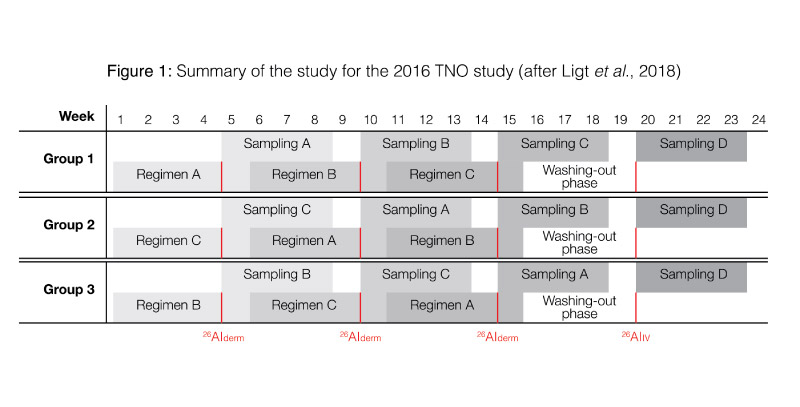
Foi escolhido um projeto crossover para este estudo para investigar a influência da (i) aplicação diária versus a aplicação única de antitranspirantes e (ii) a barba diária das axilas versus não raspar a área das axilas. Para tanto, foram definidos três regimes de uso separados, dentro dos quais ocorreu exposição à formulação antitranspirante rotulada com 26a uma vez: estes envolveram uso diário antes e depois da exposição de um padrão antitranspirante pronto para uso (sem rótulo) na pele sem barbear (regime A) ou raspado (regime B), bem como sem o uso de qualquer «tratamento adicional» (regime C). Para isso, os 12 sujeitos foram divididos em três grupos de quatro indivíduos. Os grupos diferem uns dos outros apenas em termos da ordem em que seguiram os três regimes de uso (ver Figura 1). Após a conclusão dos regimes A, B e C, seguidos de uma fase de lavagem de 4 semanas que não envolveu o uso de nenhum antitranspirante, os sujeitos receberam uma única dose intravenosa4. Isso envolveu a injeção de bolus de 5 ml de uma solução citrato de alumínio marcada com 26Al (1 Bq). Depois disso, amostras de sangue e urina matinal foram colhidas e coletadas durante um período de 28 dias.
Após a administração dérmica, as concentrações de 26Al no sangue estavam acima do limite de quantificação (0,122 fg/ml) em apenas 2 das 504 amostras, o que impediu o cálculo de qualquer perfil de tempo de concentração. Portanto, não foi possível a determinação da biodisponibilidade utilizando curvas de concentração no tempo de sangue. Em vez disso, os autores recorreram ao uso de dados de amostras de urina matinais coletadas após a administração dérmica para determinar o acúmulo de excreção na urina (veja abaixo). Foi possível quantificar a 26a em 35% (87 das 252 amostras) dessas amostras de urina, embora apenas amostras colhidas nos dias 1, 2 e 3 fossem geralmente quantificáveis.
Para os diversos cenários, a abordagem melhor- caso rendeu valores de biodisponibilidade de 0,0056% (regime A) a 0,0100% (regime C), enquanto a abordagem conservadora de pior caso rendeu valores de 0,0100 (regime A) a 0,0144% (regime C). Como resultado da grande variação dos dados, as diferenças entre os três regimes em relação à biodisponibilidade não foram estatisticamente significativas.
TNO 2019
Neste estudo, seis mulheres completaram uma fase de adaptação de duas semanas que incluiu uma barba úmida diária e o uso de um antitranspirante padrão antes de receber uma única aplicação em ambas as axilas de uma formulação contendo ACH marcada com 26A que havia sido espessada. hidroximetilcelulose. O valor total aplicado deesed 1.5 gy teve uma atividade de 2695 Bq, correspondendo a um montante aplicado de 3732 ng de 26Al. Após a aplicação de 0,75 g em cada axila (aproximadamente 100 cm2 de pele da axila), a área tratada foi deixada para secar naturalmente antes de cobri-la com uma gaze não oclusiva que aderiu sem apertar sobre a área de aplicação. Os sujeitos foram então convidados a usar uma camiseta por 24 horas. O exposto então lavou a área da pele e cobriu com gaze semi-clusive por mais 24 horas. Após esse período de 24 horas, a área da pele foi lavada novamente. A solução de lavagem, os outros materiais utilizados, a gaze e as camisetas utilizadas foram então analisadas para determinar a proporção de 26A não absorvido. Para a dose intravenosa, 5 ml de uma solução citrato de alumínio marcada com 26o (x 0,1 Bq) foi administrada por injeção de bolus.
As amostras de sangue foram então colhidas em pontos de tempo específicos por 28 dias após a aplicação dérmica. Além disso, urina e fezes foram coletadas em sua totalidade durante um período de 10 dias (referente à coleta de urina (6 hy 12 h de urina), urina 24 horas e fezes 24 horas nos seguintes casos); Urina 24 horas também foi coletada nos 14, 21 e 28. Nos dias 7 e 35 após a aplicação, também foi realizada uma «extração de fita» em uma axila para determinar os resíduos de 26Al na camada de córnea. Para isso, o corneum estrato foi removido em camadas individuais usando tiras de fita até que a superfície brilhante da epiderme viável se tornasse visível. Uma biópsia de pele também foi feita na área de pele livre de sua camada de córnea após 35 dias, para determinar a quantidade de 26al nas camadas de pele sob o córnea estrato. Uma vez que as concentrações de 26O no sangue estavam acima do limite de quantificação em apenas 12 das 84 amostras, isso reduziu a utilidade dos perfis de tempo de concentração resultantes. Neste estudo, afirmações sólidas sobre biodisponibilidade não poderiam ser derivadas de perfis de tempo de concentração sanguínea. Em vez disso, os autores recorreram ao uso de dados das amostras de urina coletadas.
Após a administração dérmica, foi possível quantificar 26al em 66% (59 de 90) das amostras de urina coletadas ao longo do período de observação. Até o dia 6 (inclusive), a proporção de amostras de urina quantificáveis foram de 90%. Após a administração intravenosa, o percentual durante todo o período foi de 98% (88 das 90 amostras). Para as últimas amostras colhidas (dia 28), a concentração de 26al em todas as amostras ficou abaixo do limite de detecção (administração dérmica) ou perto ou abaixo do limite de detecção (administração IV). Para calcular a excreção cumulativa de 26Al, os valores abaixo do limite de quantização foram fixados no limite de quantização (estimativa limite superior). No caso de um sujeito, dados toxico-líticos sugeriram que a administração intravenosa pretendida provavelmente ocorreu por intramuscular/subcutânea. Os dados obtidos a partir deste tópico foram excluídos da estatística descritiva. Durante todo o período de estudo, foi excretado na urina uma média de 0,00036% (dérmica) e 70% (IV) da dose aplicada (valor médio de 5 indivíduos).
Tomando a razão de 26A excretada na urina após a aplicação dérmica e multiplicando-a pela proporção excretada na urina após a administração intravenosa, a fração biodisponidiável após a aplicação dérmica poderia ser calculada para cada um dos cinco sujeitos restantes (ver equação na página 6). O valor médio dessa fração biodisponiária foi de 0,00052%.
Nas fezes, 0,0014% da dose dérmica foi recuperada em média. As medidas em camisetas usadas, gaze, solução de lavagem e utensílios utilizados renderam uma taxa de recuperação de 70%. A maior proporção foi encontrada em 24h na solução de lavagem (62%) e camisetas (6%). Com base na análise das tiras de fita, a taxa de recuperação da dose aplicada da camada de córnea foi de 0,0097% (após 7 dias) e de 0,0090% (após 35 dias). A biópsia da pele do perdoecido (epiderme viva e derme vizinha) rendeu uma taxa de recuperação de 0,00004% após 35 dias (valor médio de duas amostras quantificáveis).
Conclusões
Os três estudos humanos sobre a biodisponibilidade do alumínio de antitranspirantes aplicados em dérmico fornecem um conjunto muito heterogêneo de resultados. Os valores variam de 0,014% (Flarend et al. 2001) a 0,0056-0,0144% (TNO 2016), 0,00052% (orina) e 0,0014% (fezes) (TNO 2019). É necessário discutir fatores aleatórios e sistemáticos para identificar possíveis explicações dessas diferenças.
No estudo Flarend et al. No entanto, a BfR não considera esse parâmetro como o fator de influência crucial para explicar a absorção 27 vezes maior em comparação com o estudo TNO (2019). Em vez disso, as propriedades físicas e a composição da formulação utilizada proporcionam a contribuição decisiva para os resultados aqui. Ou seja: uma solução aquosa da ACH foi aplicada em vez de uma formulação cosmética viscosa.
Além do número relativamente alto de absorção dérmica em si, uma peculiaridade adicional em Flarend et al., é que a taxa mais ou menos constante de excreção urinária diária de 26Al durante um período de 14 dias, o que contrasta com a diminuição tanto no TNO (2016) quanto no TNO (2019) após o primeiro dia após a dosagem. Isso implica que o 26al tornou- se biodisponibilável a partir de um depósito dérmico de forma stepwise/atrasada. A razão para isso pode ser uma penetração mais profunda da solução aquosa nos dutos das glândulas sudoríparas, o que poderia ter resultado em exposição sistêmica prolongada. Apesar de apenas um caso de aplicação dérmica, isso poderia explicar a taxa de absorção constante por 14 dias. O cálculo para trás nesse período resultaria em uma taxa de absorção dérmica de 0,001% ao dia.
O aplicativo exclusivo em vez do aplicativo diário também leva a uma maior absorção. O estudo TNO (2016) mostra que, no caso do regime C, comparável ao desenho do estudo Flarend et al. a melhor abordagem de caso levaria a aproximadamente o dobro da quantidade de alumínio sendo absorvida pela pele em comparação com o regime A ou B (0,0100% versus 0,0056% e 0,0058%). Supondo que a via de absorção dérmica esteja sujeita à saturação, a porcentagem da quantidade absorvida depende, em última análise, da quantidade aplicada. Acima de uma certa quantidade de alumínio aplicado, a absorção não aumenta ainda mais quando esse limite de saturação é atingido. Se o alumínio dérmico for aplicado acima desse limite de saturação, a fração biodispondida diminuirá.
No estudo TNO (2016), a formulação antitranspirante foi aplicada em uma quantidade total 6 vezes maior e com uma atividade aproximadamente 20 vezes maior em relação ao Flarend et al. (2001). O fato de que, ao contrário das expectativas dos autores, a concentração de 26al no sangue não era quantificável é, na visão da RBF, quase certamente o resultado da menor disponibilidade dérmica devido às propriedades viscosas da formulação (comercial). sensibilidade analítica, que era de 1 a 2 ordens de magnitude menor. A decisão de utilizar os dados das amostras de urina da manhã, coletadas esporadicamente e apenas parcialmente analisadas, requer, em vez disso, uma série de suposições para estimar a excreção urinária cumulativa do 26Al. A estimativa resultante está associada a grandes incertezas.
A RF considera que o tempo em que a primeira amostra foi colhida, ou seja, 24 h após a administração dérmica/intravenosa, é decisivo em termos da taxa de absorção dérmica obtida dessa forma. A concentração de 26o na primeira amostra de urina da manhã foi usada para estimar a excreção de 26Al durante as primeiras 24 horas. Esta janela de tempo é uma fase muito dinâmica em que as formas das curvas de concentração do tempo de urina diferem significativamente para administração intravenosa e dérmica. Enquanto a primeira curva mostra uma queda exponencial, a segunda curva segue um caminho inicialmente ascendente para um máximo antes de descer. Dados fornecidos pelo estudo TNO (2019) indicam que a excreção renal máxima do 26Al é atingida aproximadamente 24 horas após a aplicação dérmica. Com base nos dados da primeira amostra de urina da manhã, a excreção do 26Al durante as primeiras 24 horas é, portanto, subestimada no caso da administração intravenosa e é superestimada para aplicação dérmica. Esse erro é ainda mais agravado pelo uso de ambos os valores em um cálculo subsequente. A consequência é uma superestimação significativa da excreção do 26Al durante as primeiras 24 horas, que é, em última análise, a principal razão para superestimar a absorção dérmica.
No estudo TNO (2019), a atividade na formulação antitranspirante aumentou em um fator de 25 em relação à atividade em TNO (2016). Embora isso tenha aumentado a proporção de amostras de sangue quantificáveis até certo ponto, os perfis de concentração de tempo de
sangue que podem ser derivados deste estudo são de confiabilidade limitada (ver acima). No entanto, este estudo forneceu um conjunto sólido de dados sobre a concentração de 26al na urina sistematicamente coletada, que poderia então ser usada para determinar a excreção cumulativa do 26Al. Consequentemente, o estudo TNO (2019) pode ser utilizado para derivar uma biodisponibilidade sistêmica de alumínio em antitranspirantes após aplicação dérmica de 0,00192%, compreendendo 0,00052% e 0,0014% em urina e fezes, respectivamente.
Quando os antitranspirantes de pulverização são usados, a exposição dérmica ao alumínio pode ser acompanhada de exposição não intencional ao alumínio por inalação. O SCCS concluiu uma avaliação de risco para esta rota de exposição. O SCCS baseou este trabalho em dados de dossiê (Meech et al. 2011, citados em CCS (2020)). Aqui, três frações de aerossol separadas e relevantes foram consideradas diferentes em termos de distribuição de tamanho, que são capazes de atingir os principais compartimentos dos pulmões (extrathyracic, tracheobronquilal e alveolar) (SCCS 2020). A quantidade de alumínio biodispondida por inalação resultante do uso de um aerossol padrão contendo 2,86% de alumínio equivale a 0,010582 g de peso corporal/dia de Al/kg. Para um indivíduo de 60 kg, isso equivale a uma exposição sistêmica de 0,63492 g Al/d.
Em relação à metodologia, a SCCS refere-se a um estudo experimental de Schwarz et al. (2018), em que a exposição ao alumínio por inalação de aerossóis (não alcoólicos) é modelada e calculada em condições de uso. De acordo com Schwarz et al. (2018), menos de 0,5 g de alumínio tornam-se globalmente disponíveis por uso a partir de um spray contendo 1,5% de alumínio. Se usado duas vezes por dia, isso corresponde a uma dose diária de 0,01666 g/kg de peso corporal. Se for utilizada a maior concentração de 2,86% de Al da avaliação do SCCS, é obtida uma biodisponibilidade de 0,03154 g de peso corporal/dia de Al/kg. Supondo que os aerossóis utilizados aqui não diferem significativamente em termos de seus padrões de geração de aerossol considerados pelo SCCS, o estudo schwarz et al. confirma os cálculos do SCCS.
Ao comparar a inalação com a via dérmica em termos de exposição sistêmica por aerossóis antitranspirante, a biodisponibilidade da exposição à inalação é várias ordens de magnitude maior (em comparação com uma biodisponibilidade dérmica de 0,00192%) e, portanto, contribui significativamente para a exposição global. Apesar disso, o MoS para esta rota de exposição ainda está dentro da faixa de 20000 a 70000, pois os valores disponíveis por inalação são muito pequenos.
Saiba mais sobre o assunto no site da BfR…
https://www.bfr.bund.de/cm/349/faqs-about-aluminium- in-food-and-products-intended-forconsumers.pdf
Sais de alumínio são usados em antitranspirantes para bloquear a sudorese e inibir o odor. Por muito tempo não se sabe há muito tempo quanto alumínio de antitranspirantes é absorvido pela pele. Existem atualmente três estudos em humanos de 2001, 2016 e 2019 sobre a absorção de alumínio através da pele (absorção dérmica ou biodisponibilidade) de antitranspirantes. Todos os três estudos baseiam-se na medição da concentração de alumínio no sangue e/ou urina. A conclusão científica e a relevância científica dos três estudos diferem consideravelmente.
Apenas o estudo de 2019 fornece dados confiáveis sobre os quais concluir sobre a taxa de absorção/ biodisponibilidade. O BfR utilizou esses dados como base para sua avaliação de risco e isso levou à absorção através da pele em um cálculo de modelo. O resultado foi que, segundo dados atuais, é improvável uma contribuição significativa dos antitranspirantes para a exposição total ao alumínio.
Aqueles que desejam se proteger da absorção excessiva de alumínio devem garantir que alimentos e bebidas ácidos e salgados não entrem em contato com o alumínio, por exemplo, através de garrafas, assadeiras, bandejas de grelhadas.
De acordo com o conhecimento científico atual, níveis excessivos de alumínio no corpo podem ter efeitos negativos no sistema nervoso, rins e ossos.

